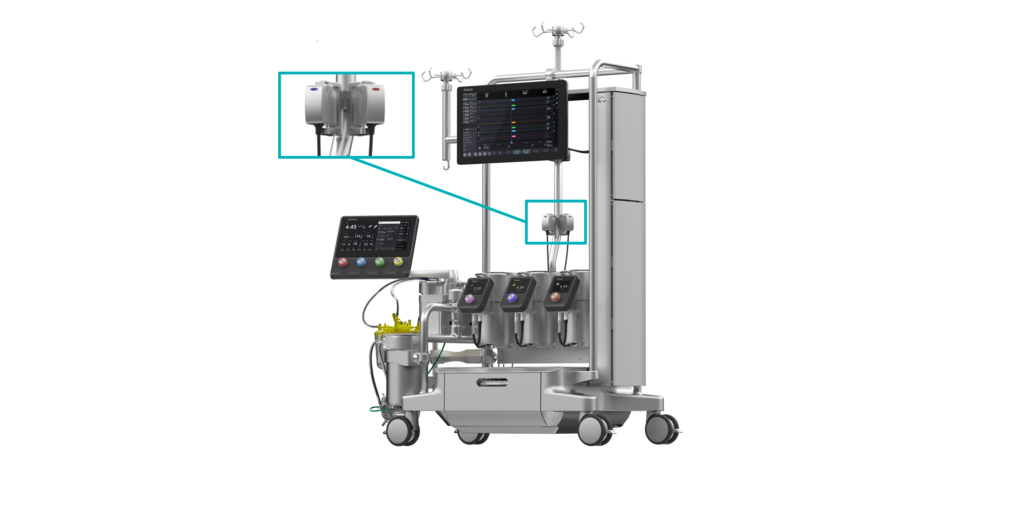
LONDRA–(BUSINESS WIRE)–LivaNova PLC (Nasdaq: LIVN), azienda leader nelle tecnologie mediche, ha oggi annunciato di aver ricevuto l’approvazione 510(k) dalla U.S. Food and Drug Administration (FDA) e il marcio CE Mark per il proprio Essenz™ In-Line Blood Monitor (ILBM), che fornisce misurazioni precise e continue di parametri essenziali del sangue ai perfusionisti grazie a procedure di bypass cardiopolmonare (CPB). La soluzione ILBM è integrata all’interno della piattaforma di nuova generazione CPB di LivaNova, ovvero l’Essenz™ Perfusion System, che consente ai perfusionisti di accedere e gestire parametri precisi relativi al sangue direttamente dal sistema stesso, senza il bisogno di avere monitor o supporti aggiuntivi.
I sistemi attuali che analizzano il sangue e i suoi parametri mostrano solo la condizione clinica di un paziente nell’esatto momento in cui viene preso un campione, che però può diventare rapidamente irrilevante per via dei costanti cambiamenti.
Il testo originale del presente annuncio, redatto nella lingua di partenza, è la versione ufficiale che fa fede. Le traduzioni sono offerte unicamente per comodità del lettore e devono rinviare al testo in lingua originale, che è l’unico giuridicamente valido.
Contacts
LivaNova Investor Relations and Media Contacts
+1 281-895-2382
Briana Gotlin
Director, Investor Relations
InvestorRelations@livanova.com
Deanna Wilke
VP, Corporate Communications
Corporate.Communications@livanova.com